Comment l’IA peut-elle permettre de stratifier le risque de maladies héréditaires rares ?
Comment l’IA peut-elle permettre de stratifier le risque de maladies héréditaires rares ? (projet CardI-HACK)
À l’occasion de l’obtention d’un financement France 2030 « Data challenges en santé » de Bpifrance, l’IHU ICAN présente un projet de recherche autour de la cardiomyopathie hypertrophique (CHM), une maladie héréditaire rare.
Mené par le Pr Philippe Charron (Professeur des Universités – Praticien Hospitalier) à l’Hôpital de la Pitié-Salpêtrière, le projet CardI-HACK vise à combiner des données génétiques et cliniques détaillées et d’appliquer l’intelligence artificielle (IA) pour progresser vers une médecine de précision à travers l’identification de nouveaux scores biocliniques capables de mieux prédire le pronostic des cardiomyopathies hypertrophiques.
Qu’est-ce que la cardiomyopathie hypertrophique ?

La Cardiomyopathie hypertrophique (CHM) est une maladie cardiaque héréditaire qui représente une cause majeure de mort subite et/ou d’insuffisance cardiaque chez les jeunes (< 40 ans).
- Cette maladie relativement rare touche 1 personne sur 500 dans la population générale.
- Elle est définie par une augmentation d’épaisseur de la paroi du ventricule gauche du cœur non expliquée par les conditions de charge.
- Jusqu’ici considérée comme monogénique, les chercheurs et médecins ont longtemps pensé que cette maladie était liée à une mutation affectant un seul gène chez le malade.
- Malgré l’amélioration des connaissances et de la prise en charge de la cardiomyopathie hypertrophique, cette maladie reste inexpliquée dans plus d’1 cas sur 3.
La maladie est en effet caractérisée par un risque de décès de 20% à 20 ans et des progrès importants ont été réalisés afin de prévenir les complications. Par exemple, lorsqu’un patient est estimé à haut risque de mort subite par trouble du rythme ventriculaire (environ 20% des patients), un défibrillateur automatique est implanté préventivement.
Les cliniciens manquent cependant d’outils performants pour proposer ces interventions au moment le plus opportun pour les patients.
Une difficulté actuelle à établir un suivi personnalisé des malades
Du fait de sa rareté, les différents recueils de données cliniques et génétiques réalisés pour cette maladie sont hétérogènes et collectés sur des cohortes de patients souvent distinctes.
À l’heure actuelle, les cardiogénéticiens des centres de maladies rares se retrouvent encore trop souvent démunis face aux résultats qui leur sont communiqués à la suite des examens génétiques et cardiologiques prescrits dans l’évaluation du bilan de la maladie. L’évolution de la maladie est en réalité éminemment variable et reste difficile à prévoir.

Ceci est particulièrement illustré chez les apparentés de leurs patients qui, avec une mutation génétique pourtant similaire, ont parfois un tableau clinique et/ou une évolution complètement différents.
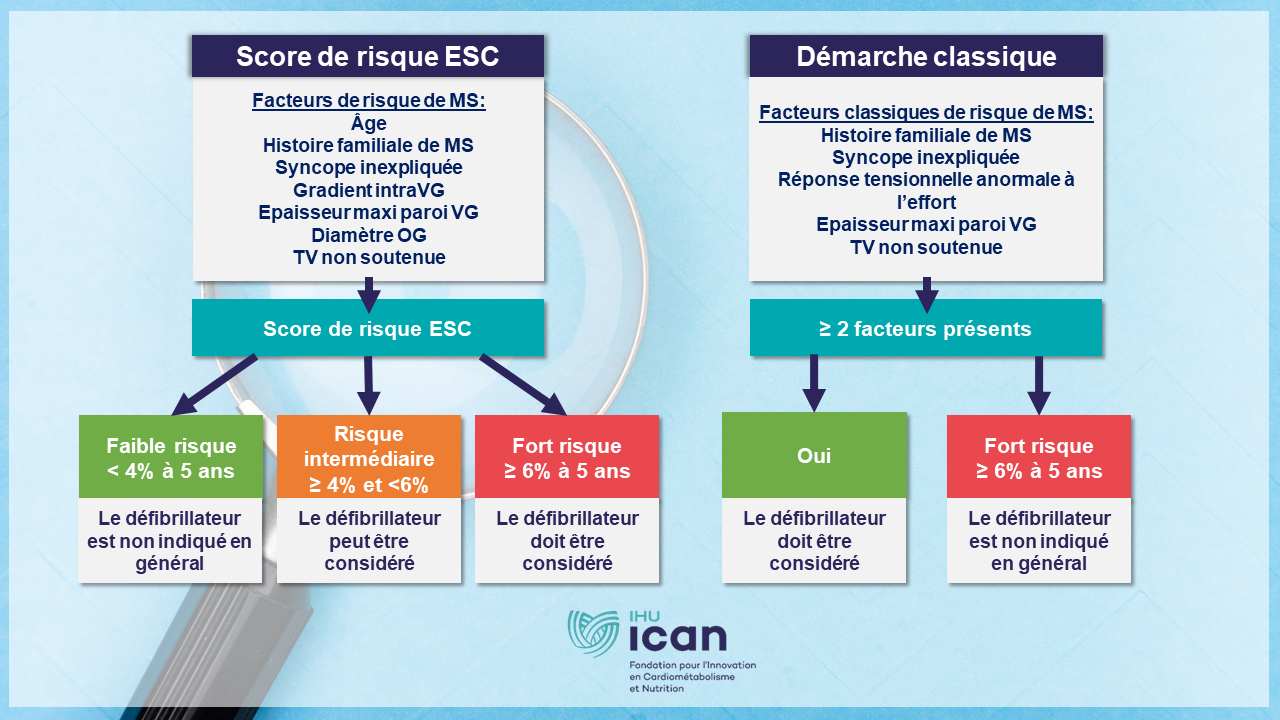
En effet, ils utilisent actuellement un calcul de risque de mort subite proposé par l’European Society of Cardiology (ESC) en 2014. La pertinence de ces scores de risque est modeste et la distinction des patients à haut risque et bas risque est insuffisante et reste controversée.
L’objectif du projet de recherche innovant CardI-HACK
Grâce aux données de plus de 500 patients souffrant de cardiomyopathies hypertrophiques (CMH), l’objectif général de ce projet est de combiner des données génétiques et cliniques détaillées et d’appliquer l’Intelligence Artificielle (IA) pour progresser vers une médecine de précision à travers l’identification de nouveaux scores biocliniques capables de mieux prédire le pronostic de ces pathologies.
Il vise à établir, au plus juste et pour chaque patient, un score de risque polygénique (SRP), c’est-à-dire une combinaison de variants génétiques à risque, et l’intégrer aux données cardiologiques afin de mieux identifier les patients qui vont bénéficier d’une prise en charge thérapeutique pro-active, notamment via l’implantation d’un dispositif médical (défibrillateur automatique endocavitaire ou sous-cutané, par exemple).
L’Intelligence Artificielle (IA) fournira une nouvelle stratification du risque avec une application translationnelle directe visant à guider la prise de décision thérapeutique. En effet, nous souhaitons qu’il permette au clinicien de connaitre le risque auquel son patient est exposé afin d’adapter la prise de décision et la fréquence de son suivi.
Le déroulé du projet

La gestion du projet CardI-HACK sera assurée par le Pr. Philippe Charron, Responsable du Centre de référence pour les maladies cardiaques héréditaires ou rares, soutenu par Aurélie Foucher, Chef de projet dans l’équipe du pôle Innovation et Valorisation de la Recherche l’IHU ICAN.
L’anonymisation des données génomiques est une question essentielle pour la réalisation du projet CardI-HACK. Combinant l’analyse de spécialistes des méthodes d’intelligence artificielle du Sorbonne Center for Artificial Intelligence (SCAI) avec l’expertise réglementaire de l’IHU ICAN et de sa déléguée à la protection des données, avec l’aide des équipes réglementaires et juridiques du Health Data Hub, une méthodologie d’anonymisation des données génomiques sera définie pour répondre aux exigences réglementaires du RGPD et à l’exigence scientifique du projet CardI-HACK et soumise à l’approbation de la CNIL.
Ce projet a obtenu un financement de Bpifrance dans le cadre de l’appel à projets « Data Challenges en santé » du plan France 2030.
Financement obtenu : 199 934€
Le soutien des mécènes et des donateurs est essentiel pour accélérer ce projet de recherche de l’IHU ICAN, et améliorer la connaissance et la prise en charge de la cardiomyopathie hypertrophique.
Vous souhaitez en savoir plus sur le mécénat à l’IHU ICAN ? Contactez Francine Trocmé à f.trocme@ihuican.org ou au 01 88 40 64 05.
L’IHU ICAN et MSDAVENIR signent un partenariat stratégique en imagerie médicale (projet ICONIC)
L’IHU ICAN et MSDAVENIR signent un partenariat pour un projet d’imagerie coeur/foie unique : ICONIC
Le fonds de dotation à la recherche en santé MSDAVENIR, du laboratoire pharmaceutique MSD France, s’engage auprès de l’IHU ICAN pour soutenir le projet ICONIC qui vise à constituer un atlas d’imagerie coeur/foie en population générale de 20 à 80 ans.
Avec la signature d’une convention de mécénat de 1,2 million d’euros, MSDAVENIR apporte un soutien majeur à la phase pilote de ce projet pour contribuer à la constitution d’un référentiel unique au monde d’imagerie cardiovasculaire et hépatique chez les jeunes adultes de 20 à 40 ans.
Cette rencontre entre imagerie médicale et épidémiologie produira des données de population uniques au monde incluant les jeunes adultes.
Projet ICONIC : le 1er atlas d’imagerie cardiaque et hépatique en population générale (< 40 ans)
Le projet ICONIC, porté par le Pr Alban Redheuil (Responsable de l’unité d’imagerie cardiovasculaire et thoracique de l’institut de cardiologie de la Pitié-Salpêtrière) sera réalisé sur la plateforme d’imagerie ICAN Imaging de l’IHU ICAN, en association avec la cohorte CONSTANCES de l’INSERM, portée par le Pr Marie Zins de l’Université Paris Cité.
Au-delà de l’importance de disposer de données de santé en population, ces données permettront une compréhension nouvelle de l’origine des maladies et du vieillissement, leur détection très précoce, la détermination de nouveaux profils de risque cardiovasculaires et métaboliques individuels et la constitution d’une cohorte d’imagerie multimodale de référence pour la recherche sur les maladies fréquentes et les maladies rares.
« ICONIC va permettre de construire la première cohorte d’imagerie française en multimodalité à la fois échographie et IRM du coeur, des vaisseaux, du foie, et du tissu adipeux en utilisant les dernières technologies et en intégrant les sujets jeunes de moins de 40 ans de la cohorte Constances. Le soutien de MSDAVENIR est absolument déterminant pour réaliser la phase pilote du projet. »
Pr Alban Redheuil, responsable de l’unité d’imagerie cardiovasculaire et thoracique de l’institut de cardiologie de la Pitié-Salpêtrière et responsable scientifique de la plateforme d’imagerie de l’IHU ICAN

« ICONIC est la rencontre de deux grandes infrastructures de recherche, la plateforme d’imagerie de l’IHU ICAN et CONSTANCES. Grâce au soutien de MSDAVENIR, nous pourrons ensemble apporter des données cruciales inédites qui permettront d’améliorer la prévention et le traitement de nombreuses maladies cardiométaboliques ».
Pr Marie Zins, médecin épidémiologiste, enseignant-chercheur à l’Université Paris Cité, directrice de l’Unité Mixte de Service 011 « Cohortes épidémiologiques en population »
« Nous sommes heureux que le fonds de dotation MSDAVENIR puisse soutenir le projet ICONIC qui ambitionne de créer un atlas unique au monde. Grâce à son approche partenariale avec la Cohorte Constances, ce programme de recherche illustre parfaitement l’ambition de notre fonds, qui est de soutenir les équipes de recherche les plus innovantes en France. »
Dominique BLAZY, Président du conseil scientifique de MSDAVENIR

CONTACTS PRESSE
IHU ICAN – Francine Trocmé – Directrice communication et mécénat – f.trocme@ihuican.org
MSDAVENIR – Emmanuelle Klein (LauMa communication) – emmanuelle.klein@lauma-communication.com
Le projet ICONIC : création du 1er atlas d’imagerie cardiaque et hépatique en population générale incluant des personnes de moins de 40 ans
Le projet ICONIC : création d’un atlas unique d’imagerie cardiaque et hépatique
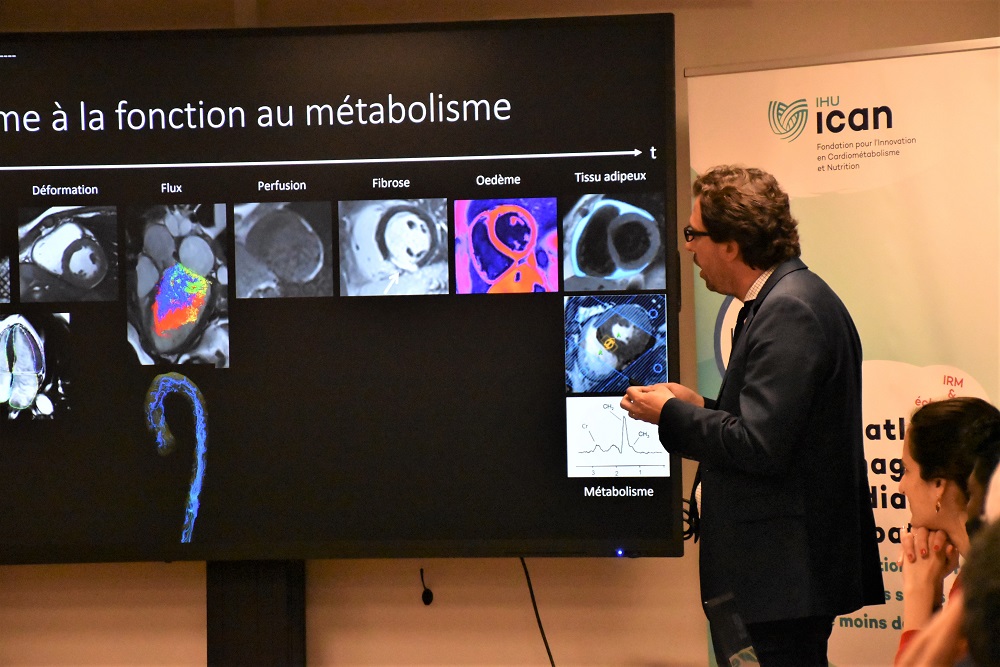
Avec le projet IMAGERIE CŒUR FOIE France (ICONIC), l’IHU ICAN a pour ambition de constituer une base de données d’imagerie cardiaque et hépatique avancée en population de référence en France, adossée à la cohorte nationale Constances (INSERM).
À partir d’examens non invasifs, ces données d’imagerie uniques permettront l’analyse de la structure et de la fonction du cœur, des vaisseaux et du foie à une échelle actuellement inexistante en France.
Le projet ICONIC, né d’un constat de manque de données

Les progrès des techniques d’imagerie permettent aujourd’hui d’explorer de nouvelles voies de recherche très innovantes. L’imagerie joue désormais un rôle central dans la compréhension in vivo des mécanismes physiopathologiques permettant une détection plus précoce des maladies, l’évaluation du risque individuel de développer une maladie et de faire une forme grave et ainsi d’améliorer la prise en charge des patients en développant une médecine personnalisée.
Pourtant, il existe une absence de données d’imagerie cardiovasculaire et hépatique en population générale et encore plus chez les 20-40 ans. Les personnes de moins de 45 ans sont très peu représentés dans les études de population comparables au niveau international.
Pour répondre à ce constat, l’IHU ICAN met en place le projet ICONIC. Ce projet permettra la validation de nouveaux biomarqueurs d’imagerie non invasifs, en créant une base de données accessible à l’ensemble de la communauté de chercheurs spécialisés.
IMAGERIE CŒUR FOIE France : une base de données ouverte, qualitative, pérenne et longitudinale
Le premier objectif du projet ICONIC sera de générer des données normatives par catégorie d’âge et de sexe issues de l’analyse des images IRM et échocardiographiques dans la population française. Ces données normatives pourront constituer une base de validation de nouveaux biomarqueurs d’imagerie et servir de contrôle pour des études fondamentales ou cliniques sur données humaines.
Les nouveaux outils diagnostiques et pronostiques ont vocation à devenir multiparamétriques en intégrant des données cliniques, biologiques et d’imagerie.
Cette base participera au décloisonnement de la médecine et sera ouverte aux médecins et chercheurs permettant aux équipes françaises de collaborer aux projets d’imagerie de population internationaux en cours et à venir.
La phase pilote du projet portera sur 2 400 participants issus de la cohorte Constances (Inserm), avec une représentation équilibrée en termes d’âge et de sexe (200 femmes et 200 hommes pour chaque décade).
Les volontaires inclus dans l’étude suivront une série d’examens biologiques et d’imagerie notamment sur la plateforme ICAN Imaging de l’IHU ICAN, située dans l’Institut de Cardiologie de l’hôpital de la Pitié-Salpêtrière, pour la réalisation des explorations comme l’IRM myocardique et l’échocardiographie transthoracique.

Véritable outil pour la recherche épidémiologique, la cohorte épidémiologique « généraliste » Constances est constituée d’un échantillon représentatif de 200 000 volontaires âgés de 18 à 69 ans inclus entre 2012 et 2019 et consultants des Centres d’examens de santé (CES) de la Sécurité sociale.
Objectifs du projet
Bénéfices patients
Durée de l'étude
Porteurs du projet
Budget global
6,8 millions d'euros
Le projet a obtenu le soutien majeur du Fonds de Dotation MSDAVENIR ainsi qu’un financement de la région Île-de-France avec le dispositif SESAME « Équipements et plateformes scientifiques et technologiques », qui s’inscrit dans le Programme d’Investissement Avenir régionalisé (SESAME filière PIA).
Photos ©Pierre Kitmacher.
SEQUOIA-HCM: Lancement d’une étude multicentrique internationale visant à étudier une nouvelle thérapie potentielle contre la cardiomyopathie hypertrophique
SEQUOIA-HCM : lancement d’une étude multicentrique internationale visant à étudier une nouvelle thérapie potentielle contre la cardiomyopathie hypertrophique
L’étude SEQUOIA-HCM, qui se déroule dans 105 centres répartis dans le monde, évalue les effets de l’aficamten sur la prise en charge de la cardiomyopathie hypertrophique (CMH), une maladie génétique qui provoque un épaississement du muscle cardiaque que l’on appelle également « l’hypertrophie ventriculaire gauche ».
Fin 2022, l’IHU ICAN a reçu la visite de Cytokinetics, entreprise biopharmaceutique américaine spécialisée dans les activateurs et les inhibiteurs musculaires et promoteur de cette étude SEQUOIA-HCM menée au sein de notre plateau d’investigation clinique ICAN Clinical Investigation.

L’investigateur principal à l’hôpital de la Pitié-Salpêtrière, Pr Philippe Charron, a collaboré avec Cytokinetics pour mener cette étude avec le soutien des études de recherche de l’IHU ICAN.
L’étude de phase III est en cours de lancement et les premières inclusions à l’hôpital de la Pitié-Salpêtrière sont prévues pour le premier trimestre 2023 !
Qu’est-ce que la cardiomyopathie hypertrophique ?
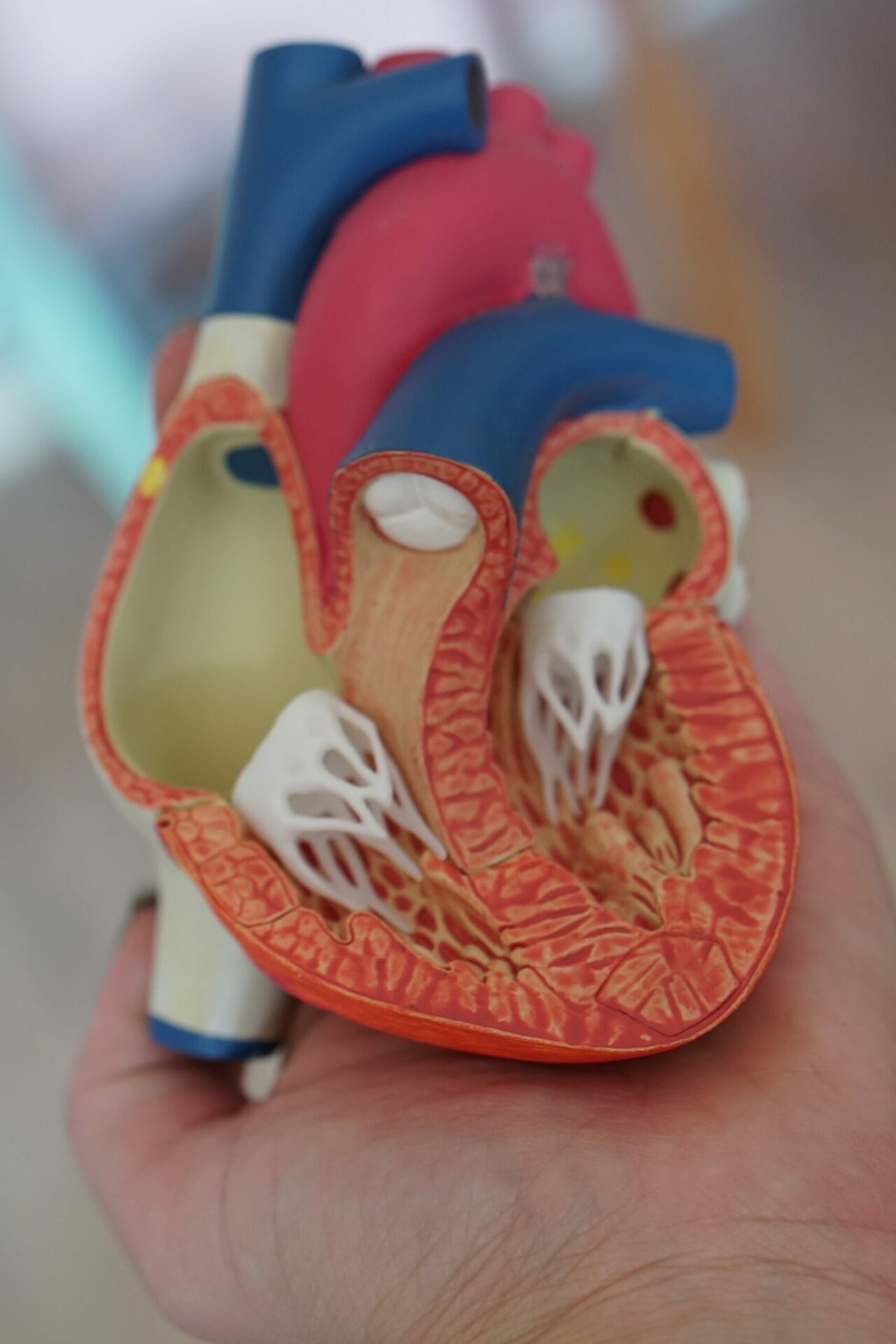
La cardiomyopathie hypertrophique (CMH) est une maladie dans laquelle le muscle cardiaque (myocarde) devient anormalement épais ce qui raidit le muscle ventriculaire gauche qui perd de sa capacité à se relaxer et à permettre le remplissage du sang.
Cette maladie relativement rare limite la fonction de pompage du coeur et entraîne des symptômes tels que la syncope ou la perte de connaissance, les douleurs thoraciques, l’essoufflement ou l’insuffisance cardiaque.
Ces symptômes apparaissent principalement au cours de l’effort, en particulier chez les patients atteints de la forme de la maladie que l’on appelle « obstructive » (CMHo). Dans certains cas la maladie se complique d’une arythmie auriculaire (avec un risque d’accident vasculaire cérébral) ou d’une arythmie ventriculaire (avec un risque de mort subite).
À l’heure actuelle il n’existe aucun traitement médical qui s’attaque directement au mécanisme responsable de la cardiomyopathie hypertrophique (CMH), c.-à-d. à l’hypercontractilité provoquée par les mutations.
L’aficamten : un médicament expérimental pour traiter la CMH
Conçue pour réduire l’hypercontractilité à l’origine de la physiopathologie de la CMH, un inhibiteur de la myosine cardiaque appelé aficamten est en cours de développement en tant que thérapie orale chronique potentielle pour les patients atteints de CMH.
SEQUOIA-HCM : une étude multicentrique internationale
Dirigée par Cytokinetics, SEQUOIA-HCM (Safety, Efficacy, and Quantitative Understanding of Obstruction Impact of Aficamten in HCM) est une étude internationale, multicentrique, randomisée, en double aveugle et contrôlée contre placebo visant à évaluer l’efficacité et la sécurité de l’aficamten chez des patients adultes atteints d’une cardiomyopathie hypertrophique obstructive symptomatique.
L’étude de phase III évaluera les effets du traitement par l’aficamten pendant une période de 24 semaines sur la capacité d’effort cardiopulmonaire et l’état de santé des patients atteints de CMHo symptomatique. Certains participants à cette étude recevront un placebo.
L’objectif principal de cette étude de phase III est d’évaluer les effets de l’aficamten :
- Sur la capacité d’effort chez des patients atteints de CMHo symptomatique ;
- Sur l’état de santé chez des patients atteints de CMHo symptomatique.
- Conformément à la classification fonctionnelle de la New York Heart Association (NYHA) ;
o Sur le gradient de la du segment post-Valsalva de la voie d’éjection ventriculaire gauche.
- Conformément à la classification fonctionnelle de la New York Heart Association (NYHA) ;
Durée de l’étude : 8,5 mois.
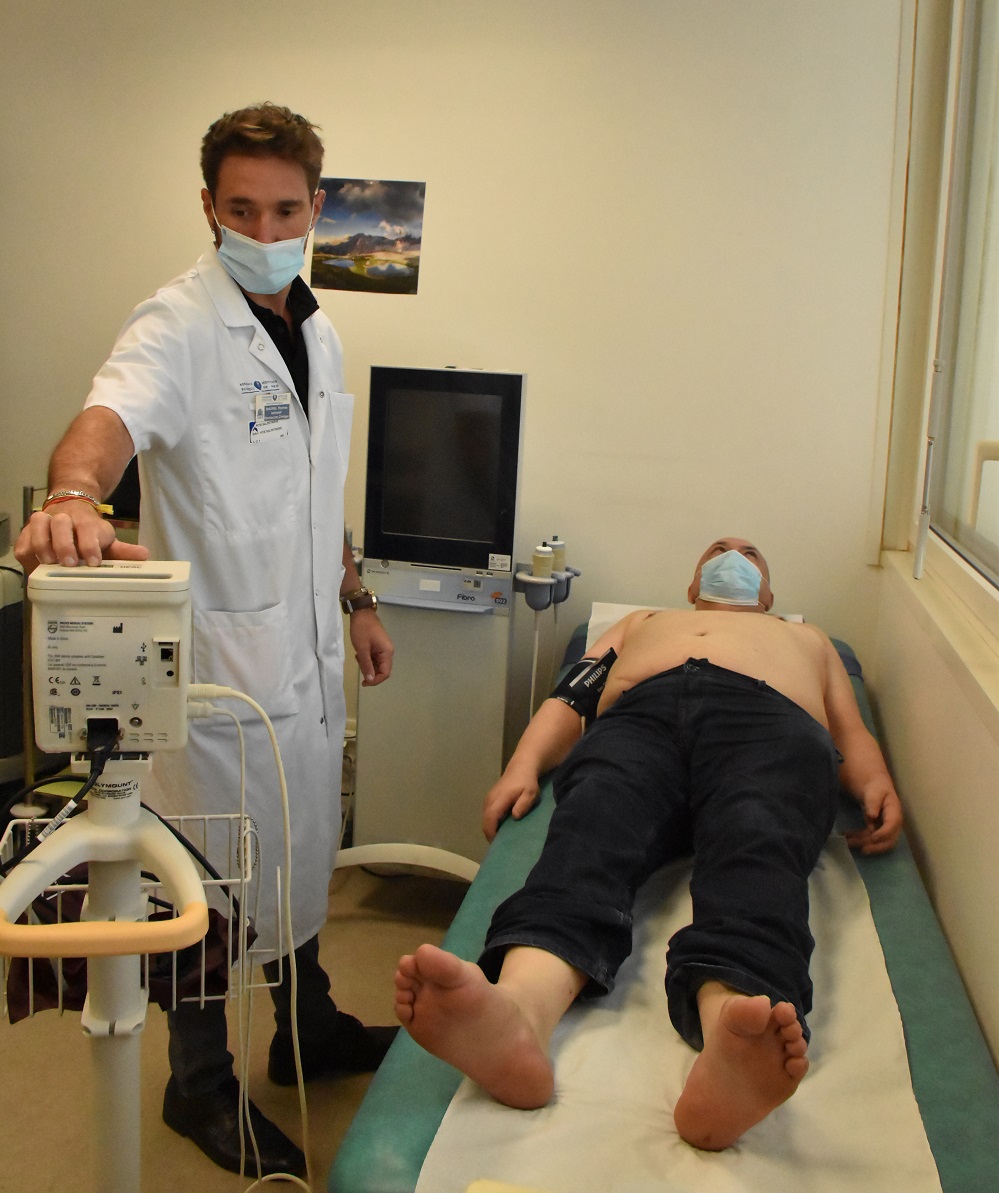
Environ 270 patients seront inclus dans cette étude dans environ 105 centres dans le monde. Les premières inclusions à l’hôpital de la Pitié-Salpêtrière sont prévues pour l’automne 2022.
Qui sont les acteurs impliqués ?
- Pr Charron (UMRS 1166/IHU ICAN) est l’investigateur principal de l’étude à l’hôpital de la Pitié-Salpêtrière (Paris 13e). Il est le coordinateur du centre de référence des maladies cardiaques héréditaires ou rares,
- Le plateau d’investigation clinique ICAN Clinical Investigation, qui assiste les promoteurs académiques et industriels pour la mise en œuvre de leurs projets cliniques et qui s’assure du bon déroulement des essais cliniques. En savoir plus.
- Le plateau d’imagerie ICAN Imaging, qui propose une technologie unique dans la région Île-de-France grâce à son IRM cardiovasculaire de dernière génération de 1,5 T. En savoir plus.
Epigénétique : les cellules souches pluripotentes induites, un modèle cellulaire prometteur pour étudier les maladies de l’empreinte parentale
Epigénétique : les cellules souches pluripotentes induites, un modèle cellulaire prometteur pour étudier les maladies de l’empreinte parentale
L’empreinte parentale est un mécanisme épigénétique qui conduit à l’expression monoallélique d’un sous-ensemble de gènes selon leur origine parentale. Les maladies de l’empreinte parentale (Imprinting Disorders, ID), causées par des perturbations des gènes soumis à empreinte, constituent un ensemble de maladies congénitales rares qui affectent principalement la croissance, le métabolisme et le développement.
Afin de modéliser la physiopathologie des maladies de l’empreinte parentale, une équipe de recherche, composée de médecins, chercheurs, doctorants de l’Inserm, Sorbonne Université et l’IHU ICAN, a développé une nouvelle approche cellulaire. Publiée le 28 décembre 2022 dans le journal Clinical Epigenetics, cette étude s’intitule « Maintien des profils de méthylation dans les régions de contrôle de l’empreinte dans les cellules souches pluripotentes humaines induites ».

Quels sont les objectifs de cette approche ?
À ce jour, il n’existe pas de modèle fiable pour étudier la physiopathologie des maladies de l’empreinte parentale chez l’être humain, première étape au développement de stratégies thérapeutiques adaptées. Les cellules souches pluripotentes induites humaines (hiPSCs) constituent une approche cellulaire prometteuse pour modéliser les maladies humaines et les troubles génétiques complexes.
Cependant, une hyperméthylation aberrante des régions de contrôle de l’empreinte (Imprinting control regions, ICR) peut apparaître pendant le processus de reprogrammation puis la culture des hiPSCs. Par conséquent, l’équipe de recherche a testé différentes conditions de reprogrammation et de culture des hiPSCs et effectué une analyse approfondie de la méthylation au niveau des régions de contrôle de l’empreinte, dans le but de développer un modèle cellulaire permettant de comprendre les maladies de l’empreinte parentale.
Quels sont les résultats de l’étude ?
Les chercheurs ont évalué la méthylation à sept loci soumis à empreinte dans les hiPSCs avant la différenciation, à différents passages de la culture cellulaire, et pendant la différenciation chondrogénique. Comme déjà décrit dans la littérature, une hyperméthylation a été identifiée au niveau des régions soumises à empreinte 11p15 H19/IGF2:IG-DMR et 14q32 MEG3/DLK1:IG-DMR, indépendamment de la méthode de reprogrammation et des cellules d’origine.
L’hyperméthylation au niveau de ces deux loci a conduit à la perte de l’empreinte parentale, avec une expression biallélique des gènes soumis à empreinte IGF2 et DLK1, respectivement dans les régions 11p15 et 14q32. Le développement du milieu de culture epiPS™ combiné à la culture des cellules en hypoxie a permis de corriger l’hyperméthylation en H19/IGF2:IG-DMR et en MEG3/DLK1:IG-DMR et de restaurer l’empreinte parentale, tout en préservant les qualités de prolifération et de pluripotence de ces cellules souches.

Quelles sont les conclusions ?
Une analyse quantitative extensive de la méthylation des régions de contrôle de l’empreinte a retrouvé une hyperméthylation à certains ICRs (ceux méthylés sur l’allèle paternel), dans les hiPSCs associée à une perte d’empreinte dans ces régions.
Le milieu de culture epiPS™ et la culture des hiPSCs en hypoxie ont permis de rétablir une méthylation équilibrée à ces loci chez les témoins. L’équipe de recherche a également pu montrer que la méthylation était perturbée dans les hiPSC dérivées d’un patient, récapitulant donc l’anomalie moléculaire responsable de sa pathologie.
Les hiPSCs, cultivées avec ce nouveau protocole, offrent donc des perspectives très intéressantes de différenciation en cellules d’intérêt impliquées dans le phénotype des patients porteurs de maladies liées à l’empreinte parentale pour en comprendre les mécanismes physiopathologiques et envisager des cibles thérapeutiques.
Les acteurs impliqués dans le projet
Ce projet est soutenu par :
- L’IHU ICAN
- Sorbonne Université
- Inserm
Les acteurs et auteurs de cette étude :
- Pr Irène Netchine, PU-PH et Cheffe De l’équipe « Système IGF et croissance fœtale et post-natale » à Sorbonne Université/Inserm/AP-HP
- Dr Aurélie Pham, CCU-AH, PhD à Sorbonne Université/Inserm/AP-HP
- Céline Selenou, doctorante à l’Inserm
- Dr Eloïse Giabicani, MCU-PH à Sorbonne Université/Inserm/AP-HP
- Dr Vincent Fontaine, PhD à l’IHU ICAN
- Sibylle Marteau, Assistant Ingénieur Culture Cellulaire iPS à l’IHU ICAN
- Dr Frédéric Brioude, MCU-PH à Sorbonne Université/Inserm/AP-HP
- Dr Laurent David, MCU-PH à Université de Nantes
- Pr Delphine Mitanchez, PU-PH Sorbonne Université/Inserm
- Dr Marie-Laure Sobrier, CR à l’Inserm
Lire la publication
Maintenance of methylation profile in imprinting control regions in human induced pluripotent stem cells. Pham A, Selenou C, Giabicani E, Fontaine V, Marteau S, Brioude F, David L, Mitanchez D, Sobrier ML, Netchine I. Clin Epigenetics. 2022 Dec 28;14(1):190. doi: 10.1186/s13148-022-01410-8.
Portrait de Laetitia, 21 ans et étudiante-chercheuse sur la cardiomyopathie dilatée
Portrait de Laetitia, 21 ans et étudiante-chercheuse sur la cardiomyopathie dilatée
À l’occasion de la Journée internationale des femmes et des filles de science du 11 février 2023 organisée par l’UNESCO, nous présentons les travaux de recherche de Laetitia Rialland, jeune doctorante en génétique moléculaire au sein de l’UMRS 1166 / IHU ICAN (Hôpital Pitié-Salpêtrière).
À 21 ans, Laetitia réalise actuellement un projet de thèse sur la compréhension des causes génétiques des cardiomyopathies dilatées humaines (1ère indication de greffe cardiaque en France et dans le monde). Elle est notamment lauréate de l’École de l’Inserm Liliane Bettencourt.

2018-2022 : une arrivée précoce dans la recherche scientifique
Très jeune, Laetitia Rialland développe un intérêt pour la médecine et les métiers tournés vers l’humain et la compréhension du vivant, avec une curiosité pour la biologie. Des études de médecine se sont donc révélées comme un choix évident, et elle rejoint la Faculté de Médecine de Nantes en 2018.
Sa rencontre avec le milieu de la recherche a lieu en 2e année de médecine, lorsque qu’elle intègre l’École de l’Inserm Liliane Bettencourt en 2020. Ce double cursus lui permet de suivre une formation précoce à la recherche, avec la réalisation d’un Master 2 au cours duquel elle effectue un stage de 6 mois (de janvier à juillet 2022) au sein de l’Hôpital Universitaire de la Pitié Salpêtrière, dans l’Unité Fonctionnelle de Cardiogénétique et Myogénétique Moléculaire et Cellulaire de Pascale Richard (MD, PhD). Cette immersion dans le milieu scientifique confirme sa passion pour la science.

Laetitia : « L’analyse des résultats est souvent le moment le plus excitant, où on découvre l’aboutissement de semaines, voire de mois de travail ! Il est générateur de nombreuses nouvelles questions et pistes à explorer. Cela peut d’ailleurs être frustrant de ne devoir se concentrer que sur certaines pistes, faute de temps. J’apprécie aussi la multidisciplinarité, être à l’interface de plusieurs disciplines passionnantes : génétique, biologie cardiovasculaire, biologie moléculaire, bio-informatique… »
« L’investissement demandé est important : certaines manipulations peuvent durer des dizaines d’heure, plusieurs jours de suite. Ce rythme intense demande une grande concentration, mais l’impatience de découvrir les fruits de son travail renforce la motivation. Il faut savoir être patient face aux délais d’attente incompressibles et mettre à profit ce temps pour anticiper les étapes futures et formuler les hypothèses nouvelles. »
2022-2025 : un projet de thèse autour des cardiomyopathies
Depuis octobre 2022, Laetitia Rialland choisit de poursuivre dans cette voie passionnante en réalisant une thèse intitulée « Analyse transcriptionnelle des causes génétiques de cardiomyopathies dilatées humaines » au sein de l’équipe 1 de l’UMRS 1166 (IHU ICAN).
Son projet de recherche, appelé projet Calorr, est basé autour de la compréhension des cardiomyopathies, qui sont des maladies affectant la structure et la fonction du muscle cardiaque. Elles débutent le plus souvent chez l’adolescent ou l’adulte jeune, et sont la 1ère indication de greffe cardiaque (71% des greffes chez les patients de moins de 40 ans).
Laetitia Rialland étudie une stratégie innovante de mRNA-seq par séquençage de 3ème génération (Long Read). L’objectif est de mieux comprendre les altérations d’épissage responsables de cardiomyopathies, afin d’envisager ensuite la définition d’un nouveau panel diagnostic par séquençage de l’ARNm qui améliorerait le rendement diagnostique.

Laetitia : « Grâce à l’utilisation de cette technologie, le projet Calorr représente une réelle opportunité d’améliorer le diagnostic moléculaire, nécessaire à la bonne prise en charge et au traitement des malades. Il est important de comprendre que, pour traiter une maladie, il faut la comprendre et connaitre son origine.
Mon quotidien ? Aucune journée ne se ressemble ! Je dirai que :
- 1/3 de mon temps de travail est consacré à des manipulations « à la paillasse »,
- 1/3 à la recherche bibliographique avec réalisation d’un état de l’art,
- Et 1/3 à l’analyse des résultats, à la mise en place des protocoles, aux formations, réunions…
Cette répartition du temps va évoluer au fur et à mesure de ma thèse, l’analyse des résultats prenant une part de plus en plus importante. La difficulté finale sera de différencier les variants qui causent la maladie des variants bénins. C’est un gros travail d’analyse et de comparaison des données, qui va s’étaler sur mes 3 années de doctorat à venir. »
Différents acteurs sont impliqués dans l’avancée du projet, notamment :
- Eric Villard (Directeur de thèse) et Phillipe Charron (Responsable d’équipe, UMRS 1166 / IHU ICAN),
- Pascale Richard pour la partie sur le diagnostic établie (Unité Fonctionnelle de Cardiogénétique et Myogénétique Moléculaire et Cellulaire), avec qui Laetitia continue également de travailler sur son projet de recherche de Master 2,
- L’équipe de l’UMRS 1166,
- La Plateforme Post-génomique de la Pitié-Salpêtrière (P3S) pour le séquençage,
- La plateforme ICAN I/O pour l’analyse bio-informatique,
- La société Oxford Nanopore pour l’utilisation de la technologie de séquençage Long Read.
Après 2025 : quel avenir dans la recherche ?
Laetitia : « La génétique des cardiomyopathies est une discipline qui a beaucoup évolué :
- En 2001, le 1er séquençage du génome humain avait lieu après 15 années de travail impliquant des centaines de chercheurs.
- En 2022, le nouveau record de séquençage du génome humain est établi à 7 heures et 18 minutes.
Même si ce record reste exceptionnel, cela montre que la recherche scientifique améliore constamment ses capacités technologiques. Cela a permis, dans les dernières décennies de découvrir un grand nombre de gènes impliqués dans les cardiomyopathies et d’améliorer considérablement la prise en charge de ces patients. Dans les prochaines années, on pourra générer de plus en plus de données de séquençage, mais l’enjeu sera de réussir à comprendre et analyser toutes ces données. »

Après l’obtention de sa thèse, Laetitia souhaite reprendre ses études de médecine en 4e année et continuer en parallèle la recherche avec l’Ecole de l’Inserm Liliane Bettencourt. Elle aspire à une carrière hospitalo-universitaire afin de partager son temps entre l’activité de recherche et le contact direct avec les patients.
« Ce parcours passionnant demande beaucoup de travail, d’investissement et de motivation ! J’encourage toutes les femmes et les filles intéressées par la recherche scientifique à se lancer. Je n’ai rencontré aucun frein à être une femme dans ce milieu, et nous sommes même majoritairement représentées dans certaines disciplines. »
Traitement de l’obésité : étude sur les mécanismes protecteurs des acides gras oméga-3
Traitement de l’obésité : étude sur les mécanismes protecteurs des acides gras oméga-3
L’obésité est aujourd’hui un enjeu majeur de santé publique. D’après l’OMS (Organisation Mondiale de la Santé), au moins 2,8 millions de personnes décèdent chaque année en raison de leur surpoids ou de leur obésité. Le nombre d’enfants et d’adolescents obèses a été multiplié par 10 au cours des 4 dernières années.
L’obésité est fréquemment associée à des désordres métaboliques, tels que la résistance à l’insuline, le diabète de type 2 et les maladies du foie non alcoolique, qui sont des facteurs de risque importants pour les maladies cardiovasculaires.

Soutenu par la Fondation Carrefour et porté par le Dr. Wilfried Le Goff (INSERM UMR_S1166 – IHU ICAN), le projet de recherche intitulé « Etude des mécanismes protecteurs des acides gras oméga-3 dans l’obésité » a pour objectif de permettre une meilleure compréhension des effets bénéfiques des acides gras polyinsaturés oméga-3 dans l’obésité. Il permettra ainsi de proposer de nouvelles approches thérapeutiques pour lutter contre le développement de la résistance à l’insuline et du diabète de type 2.
Le rôle des graisses non saturées dans la prévention de l’obésité

Une mauvaise alimentation constitue un facteur de risque important dans le développement de l’obésité, du diabète et des maladies cardiovasculaires. L’OMS recommande de limiter l’apport énergétique provenant de la consommation de graisses en réduisant la consommation de graisses saturées au profit de graisses non saturées.
Quoique le rôle bénéfique des graisses non saturées dans la prévention des désordres métaboliques associés à l’obésité soit largement accepté, les mécanismes sous-jacents sont toutefois moins clairs.
Ces derniers reposeraient principalement sur les effets protecteurs associés aux acides gras polyinsaturés (AGPI) de type oméga-3 notamment contre le développement de la résistance à l’insuline, du diabète de type 2 et des maladies cardiovasculaires.
D’un point de vue mécanistique, les AGPI oméga-3 réduiraient notamment l’inflammation du tissu adipeux, l’organe de stockage des acides gras, à l’origine du développement de la résistance à l’insuline et du diabète de type 2 au cours de l’obésité. Toutefois, les mécanismes précis ne sont pas connus.

L’étude des mécanismes protecteurs des acides gras oméga-3
Les travaux de l’équipe du Dr W. Le Goff (INSERM UMR_S1166 – IHU ICAN) ont permis d’identifier une enzyme qui module le contenu en AGPI oméga-3 des macrophages, les cellules clés qui contrôlent l’inflammation dans le tissu adipeux. Les résultats préliminaires indiquent que l’expression de cette enzyme mobilise les AGPI oméga-3 des membranes des macrophages pour réduire l’inflammation.

Ce projet de recherche actuel vise donc à déterminer si l’action bénéfique des AGPI oméga-3 sur le développement de la résistance à l’insuline et du diabète de type 2 au cours de l’obésité requiert l’action anti-inflammatoire de cette enzyme dans les macrophages du tissu adipeux.
Le projet permettra une meilleure compréhension des effets bénéfiques des AGPI oméga-3 dans l’obésité et permettra de proposer de nouvelles approches thérapeutiques pour lutter contre le développement de la résistance à l’insuline et du diabète de type 2.
Au sein de l’IHU ICAN, la plateforme ICAN Omics réalisera les analyses lipidomiques.
Ils soutiennent ce programme de recherche
Le soutien de la Fondation Carrefour contribuera au financement d’un poste de chercheur en contrat doctoral, de l’isolement des macrophages du tissu adipeux de patients obèses par tri cellulaire et de leur analyse transcriptomique.
Ce programme de recherche bénéfice également des financements de la Société Francophone du Diabète, de l’Alliance Sorbonne Université (Programme Emergence) et de l’Agence Nationale de la Recherche (ANR).


« Le soutien de la Fondation Carrefour sera essentiel pour ce programme de recherche étudiant la contribution du remodelage lipidique membranaire des macrophages du tissu adipeux dans le rôle anti-inflammatoire des AGPI oméga-3. Ces travaux qui seront menés par une chercheuse doctorante de notre équipe permettront des avancées majeures dans la compréhension des mécanismes protecteurs des AGPI oméga-3 dans l’obésité. »
Wilfried Le Goff – Chef d’équipe Métabolisme lipidique cellulaire dans les maladies cardiovasculaires – UMR 1166 / IHU ICAN
Où en est la recherche médicale pour lutter contre le diabète de type 2 (DT2) ?
Où en est la recherche médicale pour lutter contre le diabète de type 2 (DT2) ?
Maladie chronique de plus en plus fréquente, le diabète de type 2 (DT2) est caractérisée par une élévation du taux de sucre dans le sang, aussi appelée hyperglycémie. Il concerne 92% des patients diabétiques, soit environ 3,6 millions de français, et touche généralement des personnes de plus de 40 ans.
Grâce à une recherche médicale active depuis de nombreuses années, des avancées scientifiques permettent de mieux comprendre cette pathologie, et de développer des traitements au bénéfice des patients. Où en est la recherche médicale et scientifique autour du diabète de type 2 ?
Découvrez ci-dessous le témoignage du Pr. Fabrizio Andreelli, qui contribue aux travaux de recherche du service de Diabétologie-Métabolismes de l’Hôpital de la Pitié-Salpêtrière, et de l’unité Nutriomics (INSERM / IHU ICAN).

Quel rôle du microbiote intestinal dans le DT2 ?
Le microbiote intestinal est l’ensemble des micro-organismes (dont des bactéries) présents dans les intestins. Nos équipes de recherche s’intéressent au lien entre le microbiote et le diabète de type 2.
Elles ont remarqué que les populations en surpoids présentent un déséquilibre dans la composition de ces bactéries intestinales et un appauvrissement de la diversité (variété) de la flore intestinale. Ce phénomène s’intensifie pour les patients en surpoids atteints de DT2, qui présentent davantage d’altérations dans la diversité de leur flore.
Un microbiote intestinal appauvri peut-il favoriser l’obésité et le diabète de type 2 ?
Au sein de notre laboratoire, nos équipes de recherche contribuent donc à analyser ces espèces bactériennes afin de mieux les connaître et afin de rétablir une flore équilibrée chez nos patients, dans le but de limiter leur prise de poids et d’améliorer leur taux de glycémie (taux de sucre dans le sang), en cas de diabète de type 2.
Quel impact de la chirurgie bariatrique dans le DT2 ?

La recherche a permis de prouver que la perte de poids améliore le diabète de type 2. En effet, l’activité physique et l’alimentation équilibrée font partie des mesures hygiéno-diététiques qui permettent de traiter le DT2 en première intention, avant les traitements médicamenteux par voie orale ou par injections.
Dans certaines populations, la chirurgie bariatrique qui vise à perdre du poids (pose d’un anneau gastrique ou chirurgie plus complexe qui crée un court-circuit intestinal) permet de normaliser le taux de glycémie du patient en post-opératoire, et même dans certains cas de faire disparaitre le diabète de type 2. Ce phénomène a pu être observé rapidement après l’intervention (jours ou semaines), bien avant que le patient ne commence à perdre du poids.
Quel(s) mécanisme(s) améliore(nt) la glycémie après une chirurgie bariatrique, avant toute perte de poids significative ? Est-ce l’opération en elle-même qui permet d’induire de nouveaux signaux, afin de réveiller les cellules qui secrètent l’insuline dans le pancréas ?
Au sein de notre laboratoire, ces questions ont été abordées à l’aide d’un modèle de souris, en recréant le même contexte que chez les patients humains. Chez la souris et chez l’humain, il a donc été démontré que la chirurgie bariatrique peut réveiller le pancréas endocrine, c’est-à-dire la partie du pancréas qui sécrète l’insuline, hormone capitale pour contrôler le taux de sucre dans le sang (glycémie). Ainsi, chez l’homme comme chez le rongeur opéré, on observe une hausse de la sécrétion d’insuline permettant l’amélioration des glycémies, voire la disparition, du diabète de type 2.
L’analyse des mécanismes impliqués dans l’amélioration du diabète après la chirurgie bariatrique a permis de révéler l’implication de la cellule bêta du pancréas (pancréas endocrine), qui va retrouver une fonctionnalité optimale ce qui la rend de nouveau capable de sécréter l’insuline selon les besoins de l’organisme afin de réguler la glycémie dans le sang.
Nos équipes travaillement maintenant à identifier les substances qui pourraient partir de l’intestin opéré et qui ciblent le pancréas endocrine, permettant ainsi sur la base de la communication entre ces deux organes d’expliquer comment l’intestin opéré améliore la fonctionnalité du pancréas. L’identification de ces substances pourrait amener à la création de nouveaux médicaments ou de solutions nutritionnelles afin d’équilibrer les glycémies des patients atteints de diabète de type 2 sans chirurgie bariatrique.

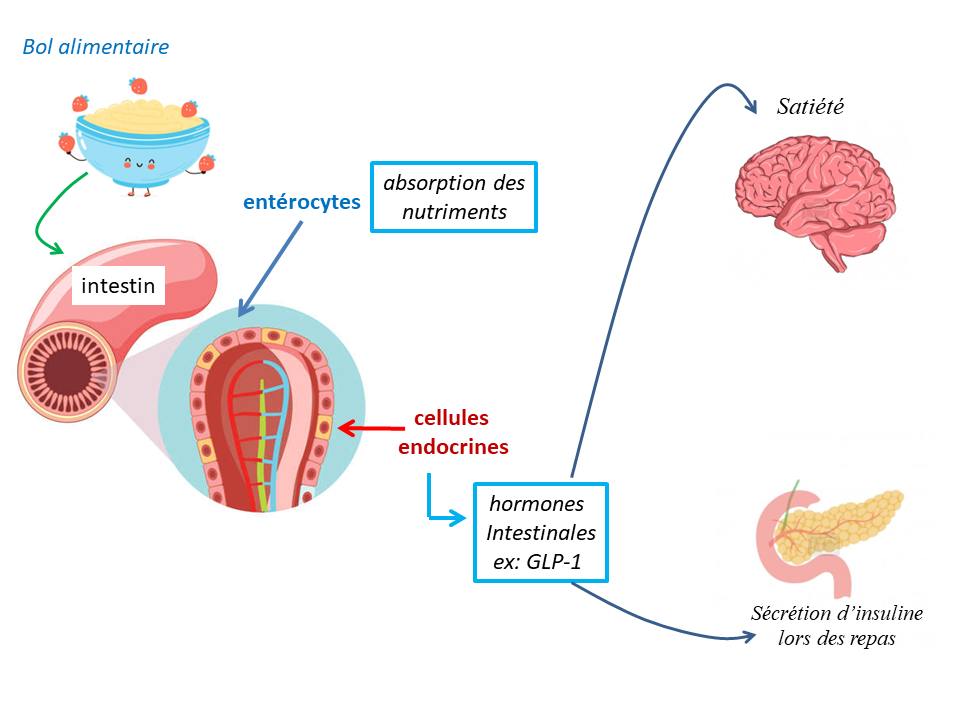
Quel impact du DT2 sur le système intestinal ?
Chez les patients atteints de diabète de type 2 et en surpoids, le fonctionnement hormonal du système intestinal est altéré. En effet, l’intestin a d’autres fonctions que la seule absorption des aliments. Certaines cellules intestinales sont spécialisées en des sécrétions d’hormones essentiellement sécrétées lors des repas. Ces hormones ont une double fonction : atteindre le pancréas afin de sécréter plus d’insuline pour équilibrer la glycémie lors des repas ; et induire la satiété. La fabrication de ces hormones appelées hormones incrétines est défectueuse en cas d’obésité et de diabète de type 2, ce qui empêche le pancréas endocrine de libérer plus d’insuline et réduit également le message de satiété envoyé au cerveau.
Le fonctionnement classique du système intestinal
- Le microbiote (bactéries intestinales), au contact des aliments, va interagir avec l’intestin qui va libérer des hormones intestinales, ou hormones incrétines (comme le GLP-1), qui vont circuler dans le sang et avertir l’organisme que le repas est en train d’arriver.
- À la réception de ces hormones, d’une part le pancréas va secréter plus d’insuline, et d’autre part le cerveau est informé que la satiété doit se préparer.
Comment améliorer la sécrétion des hormones incrétines manquantes pour augmenter la sécrétion l’insuline nécessaire au contrôle des glycémies ?
L’identification d’une des hormones incrétines, appelée le GLP-1, a récemment permis aux équipes de recherche de développer un médicament pour traiter le diabète de type 2. Ce traitement se présente sous la forme d’un stylo prérempli de GLP-1, permettant une injection hebdomadaire sous-cutanée. Il va permettre de redonner à l’organisme cette hormone importante, qui n’est plus ou mal fabriquée par l’intestin.
Ce médicament est disponible pour les patients atteints de DT2, et est de plus en plus recommandé lorsque les modifications du mode de vie ne suffisent pas (activité physique, alimentation…).
Une nouvelle génération de médicaments devrait être disponible en 2023-2024, avec des stylos comprenant 2, voire 3 hormones intestinales différentes, afin de renforcer les effets sur la satiété et sur la sécrétion du pancréas endocrine.
« C’est un énorme espoir pour tous les patients. Cela permettra ainsi d’éviter que le diabète soit déséquilibré, de réduire les risques de complications, et de permettre une meilleure santé. » témoigne Pr. Fabrizio Andreelli, Service de diabétologie de l’Hôpital de la Pitié-Salpêtrière.
Projet CAVD : comment reconstituer in vitro un tissu cardiaque contractile mature ?
Projet CAVD : comment reconstituer in vitro un tissu cardiaque contractile mature ?
La Cardiomyopathie Arythmogène du Ventricule Droit (CAVD) est la cardiomyopathie qui représente une des principales causes de mort subite chez les patients jeunes de moins de 40 ans. Elle est caractérisée par une inflammation massive du tissu cardiaque qui s’accompagne d’une perte progressive des cellules musculaires, les cardiomyocytes, qui sont remplacés par des infiltrats fibro-graisseux conduisant à un risque accru d’arythmies ventriculaires potentiellement mortelles.
Mené par le Dr Pierre Bobin, le projet CAVD vise à utiliser des pseudo-tissus cardiaques artificiels (EHT), dérivés de cellules souches pluripotentes induites humaines, en tant qu’outil de recherche translationnelle devant permettre à moyen terme de tester de nouvelles approches dans le traitement de la CAVD.

Qu’est-ce que le projet CAVD ?

Le projet CAVD vise à développer et à améliorer la technologie des pseudo-tissus cardiaques artificiels (plus connus sous l’acronyme EHT pour Engineered Heart Tissues) dérivés de cellules souches pluripotentes induites humaines (hiPSC) afin de reconstituer in vitro un tissu cardiaque contractile mature reproduisant un stress mécanique tel qu’observé in vivo et capable de reproduire des phénotypes cellulaires et structuraux de la CAVD.
Le projet s’appuie sur des résultats préliminaires encourageants obtenus lors des trois premières années de développement de la technologie des EHT dans l’unité de recherche du Pr Estelle Gandjbakhch et du Dr Eric Villard. Il repose sur la création de lignées de cellules souches à partir de prélèvements sanguins réalisés chez des patients porteurs de mutations génétiques associées à la CAVD.
Ce projet doit ainsi permettre de développer un modèle tissulaire humain génétiquement ajustable, permettant non seulement l’observation et l’étude de la désorganisation tissulaire observée en phase terminale, mais aussi et surtout la reproduction de l’évolution de la CAVD tout au long de ses multiples phases de développement.
Le caractère innovant et unique du projet
Le développement de ce modèle, unique en France à l’heure actuelle, associé à l’utilisation de techniques et de technologies de pointe telles que l’utilisation de cellules souches iPS associée à des techniques d’édition du génome, doit permettre d’étudier les mécanismes pathologiques induits par les deux mutations majeures associées à la CAVD dans le contexte génétique du patient.
Cette nouvelle stratégie ouvre ainsi la voie à une utilisation des EHT en tant qu’outil de recherche translationnelle devant permettre à moyen terme de tester de nouvelles approches dans le traitement de la CAVD telles que la thérapie génique, avec pour horizon le développement d’une approche médicale personnalisée des pathologies cardiaques d’origine génétique.

Le mécénat au service de l’innovation
Crédit Agricole d’Ile-de-France Mécénat a accepté de soutenir ce projet de recherche innovant en 2022 et a ainsi rejoint la communauté des mécènes de l’IHU ICAN.
Dans ce cadre, nous avons eu le plaisir d’accueillir la visite de leur délégation pour une présentation du projet par l’équipe de recherche dédiée : le Pr E. Gandjbakhch (Responsable de l’unité de rythmologie de l’Institut de Cardiologie Hôpital de la Pitié-Salpêtrière), le Dr E. Villard (Responsable scientifique) et le Dr P. Bobin (Chercheur post doctorant) dans l’équipe Génomique et Physiopathologie des Maladies du Myocarde de l’UMRS 1166.
Cette rencontre a permis aux membres de la délégation de découvrir les laboratoires de recherche de l’UMRS 1166 ainsi que le laboratoire de culture cellulaire dans lequel sont développés les pseudo tissus cardiaques (EHT), modèle unique en France à l’heure actuelle.
« Le soutien de Crédit Agricole d’Ile–de–France Mécénat est important pour l’équipe, il va nous permettre d’accélérer concrètement nos travaux de recherche qui sont très couteux car il s’agit de techniques très innovantes », explique Pierre Bobin, Chercheur post-doctorant en physiologie cardiovasculaire.
Les acteurs impliqués dans le projet
Ce projet est soutenu par :
- L’IHU ICAN
- Crédit Agricole d’Ile-de-France Mécénat
- Le Fonds Marion Elizabeth Brancher
- La Fédération Française de Cardiologie
- La Ligue contre les Cardiomyopathies
- Microport
Les partenaires de ce projet :
- Le Département de Cardiologie de l’Hôpital de la Pitié Salpêtrière (AP-HP) et le Centre de référence des maladies cardiaques héréditaires ou rares de Paris (CRMR)
- ICAN BioCell-iPS
- L’UMRS 1166 (INSERM – Sorbonne Université)
- ICAN Omics metabolomics
- ICAN Omics lipidomics
- Plateforme de cytométrie
Photos ©Alkama.
MetaGenoPolis-INRAE et l’IHU ICAN accélèrent la recherche sur le microbiote et les maladies cardiovasculaires en France
MetaGenoPolis-INRAE et l’IHU ICAN accélèrent la recherche sur le microbiote et les maladies cardiovasculaires en France
MetaGenoPolis-INRAE et l’IHU ICAN, tous deux reconnus dans la communauté scientifique à l’international pour leurs travaux de recherche et faisant partie du démonstrateur pré-industriel MetaGenoPolis, souhaitent allier leurs forces pour accélérer les connaissances sur le lien entre microbiote et maladies du cardiométabolisme.

Quel impact du microbiote dans les maladies cardiovasculaires ?
Diabète, obésité, cirrhose, maladies du foie (NASH), maladies du cœur et des vaisseaux sont des maladies chroniques en constante augmentation ces cinquante dernières années, dont certaines de façon incontrôlée. Elles constituent des enjeux de santé publique d’aujourd’hui et de demain.
Ces maladies du cardiométabolisme, touchant enfants et adultes, sont en effet la 1ère cause de décès en France et dans le monde. Mieux combattre ces maladies se fera par une recherche innovante et pluridisciplinaire permettant de proposer une prise en charge personnalisée aux patients.
La science a montré que ces maladies pourraient être associées à un déséquilibre du microbiote intestinal.
Il est nécessaire de continuer à explorer l’impact du microbiote dans les maladies cardiovasculaires pour ouvrir de nouvelles voies thérapeutiques.
Quelle collaboration entre MetaGenoPolis-INRAE et l’IHU ICAN ?
Dans le cadre du projet Le French Gut, contribution nationale porté par INRAE en collaboration avec l’AP-HP qui collectera les microbiotes intestinaux de 100 000 personnes majeures volontaires résidant en France métropolitaine ainsi que les données nutritionnelles et cliniques associées d’ici 2027, la collaboration INRAE/ICAN permettra de créer des synergies dans des projets ancillaires pour accélérer les connaissances sur les relations entre le microbiote intestinal et les maladies cardiométaboliques en France.
En effet, plusieurs cohortes de patients sous l’égide de l’IHU ICAN pourraient rejoindre le French Gut afin de pouvoir étudier cette relation.
Des liens privilégiés entre MetaGenoPolis-INRAE et l’IHU ICAN existent déjà, notamment au travers de 2 projets internationaux MetaHIT et Metacardis qui ont donné lieu à des publications à haut impact facteur, et plus récemment à des réflexions communes pour proposer des offres à destination des industriels souhaitant explorer le microbiote et son impact sur la santé.


« Qu’elles soient à des fins de diagnostic, de traitement, ou de prévention par la nutrition, ces offres de partenariat inclus les expertises uniques de ces deux instituts (clinique, métagénomique et Intelligence artificielle) et bénéficient de plateaux techniques de haute qualité pour répondre à une demande de plus en plus innovante et personnalisée de nos partenaires économiques. »
Alexandre Cavezza, PhD – Directeur MetaGenoPolis
Qui est MetaGenoPolis ?
MetaGenoPolis (MGP), unité INRAE, est experte en recherche sur le microbiote intestinal appliquée à la santé et à la nutrition humaine et animale, pour accélérer la science et l’innovation. Financée par le Programme des Investissements d’Avenir (Lauréat 2012 et 2019), MGP a été coordinateur de 2 grands projets qui ont permis de faire avancer la science du microbiote :
- Le projet MetaHIT qui publie le 1er catalogue de gènes microbiens intestinaux humains,
- Le projet IHMS pour aider à normaliser l’analyse de l’ADN microbien.

Depuis sa création en 2012, MetaGenoPolis a collaboré sur 236 projets de recherche dont 154 projets en partenariat avec les industriels.
MGP a pour missions principales :
- D’accélérer la science du microbiote en France et l’innovation dans le domaine de la santé et de l’alimentation,
- De proposer des technologies performantes et à haut débit pour analyser la diversité des microbiotes complexes et les interactions entre les bactéries intestinales et les cellules humaines,
- De collaborer avec les acteurs industriels pour la transformation de leurs découvertes en produits et services liés à la santé, pour identifier et traiter pleinement les pistes vers de futures applications industrielles, pour aider à concevoir et conduire des projets scientifiques vers des applications.
L’excellence scientifique de MGP dans l’analyse du microbiote intestinal et de ses implications pour la santé et la nutrition est largement reconnue dans la communauté scientifique internationale.