Adopter un régime alimentaire pauvre en glucides est souvent indiqué pour la perte de poids et le traitement de maladies chroniques comme le diabète de type 2.
Pourtant, certaines études ont relevé que cette modification alimentaire peut entraîner une augmentation du cholestérol dit « LDL » ou « mauvais cholestérol », qui est un facteur de risque important dans le développement de maladies cardiovasculaires.
Compte tenu de la popularité grandissante des régimes pauvres en glucides et de la forte mortalité liée aux maladies cardiovasculaires, il convient de comprendre les mécanismes qui impactent le taux de cholestérol LDL et le métabolisme des lipides, en réponse à une diminution des glucides.

Anatol Kontush (Directeur de recherche au sein de l’UMRS 1166 – IHU ICAN) a contribué, comme co-dernier auteur, à la réalisation de l’article scientifique « The Lipid Energy Model: Reimagining Lipoprotein Function in the Context of Carbohydrate-Restricted Diets », publié dans le 20 mai 2022 dans Metabolites.
Quel est l’objectif de l’étude ?
L’étude s’appuie sur les données auto-collectées de 548 individus suivant un régime pauvre en glucides (CRD), correspondant à moins de 130 grammes par jour, avec un apport moyen de 27 grammes de glucides par jour.
Une première analyse a permis d’identifier des éléments qui permettent de prédire l’augmentation du cholestérol LDL (LDL-C) :
- L’indice de masse corporelle (IMC) de l’individu,
- Les marqueurs métaboliques de sa santé,
- Le taux de cholestérol HDL (HDL-C),
- Le taux de triglycérides (TG) avant le régime alimentaire.

Rappel : Les glucides sont les nutriments énergétiques principaux du corps humain, réparties en deux familles : les glucides simples (fruits, lait, yogourt, chocolat, confitures, sucre raffiné…) et les glucides complexes (pain, céréales, riz, pâtes, légumineuses, pommes de terre…).

L’analyse a révélé que les personnes maigres (possédant donc un IMC bas) avec un faible rapport TG/HDL-C, et qui suivent un régime alimentaire pauvre en glucides, étaient les plus susceptibles de connaître des augmentations de leur taux de cholestérol LDL.
Cela a permis d’isoler un sous-ensemble de 100 individus « Lean Mass Hyper-responder » (LMHR) présentant des augmentations particulièrement fortes de leur taux de cholestérol LDL mais aussi HDL dans un contexte de restriction des glucides, combiné avec un faible taux de triglycérides. Le mécanisme était réversible avec la réintroduction de glucides dans le régime alimentaire, et aucun facteur génétique notable n’a été révélé lors des tests.
L’objectif de cette publication scientifique est donc d’apporter une explication au phénotype LMHR, à l’aide du « Lipid Energy Model » (LEM).
Qu’est-ce que le Lipid Energy Model ? (LEM)
Le Lipid Energy Model (LEM) est une hypothèse selon laquelle, dans des conditions de restriction des glucides et la présence de graisse dans le tissu cellulaire sous-cutané, il réside une plus grande dépendance à l’égard des graisses en tant que substrat métabolique, telles que fournies par les lipoprotéines riches en triglycérides, y compris les VLDL (lipoprotéines de très basse densité) synthétisées et sécrétées par le foie.
Augmentation du LDL-C et du HDL-C par la lipoprotéine lipase
En présence d’une augmentation de la synthèse et de la sécrétion des VLDL, l’activité de la lipoprotéine lipase (LPL) libère des acides gras libres (AGL = non-esterified fatty acids = NEFA) pour les adipocytes et les tissus oxydatifs. Au fur et à mesure que les TG sont lipolysés, les VLDL rétrécissent avec la perte des résidus de surface (y compris le cholestérol, les phospholipides et les apolipoprotéines) au profit des particules acceptrices de HDL, puis sont catabolisés en LDL, ce qui entraîne une augmentation de la masse des particules LDL, du LDL-C, de la masse des particules HDL et du HDL-C. Source : Metabolites 2022, 12(5), 460.
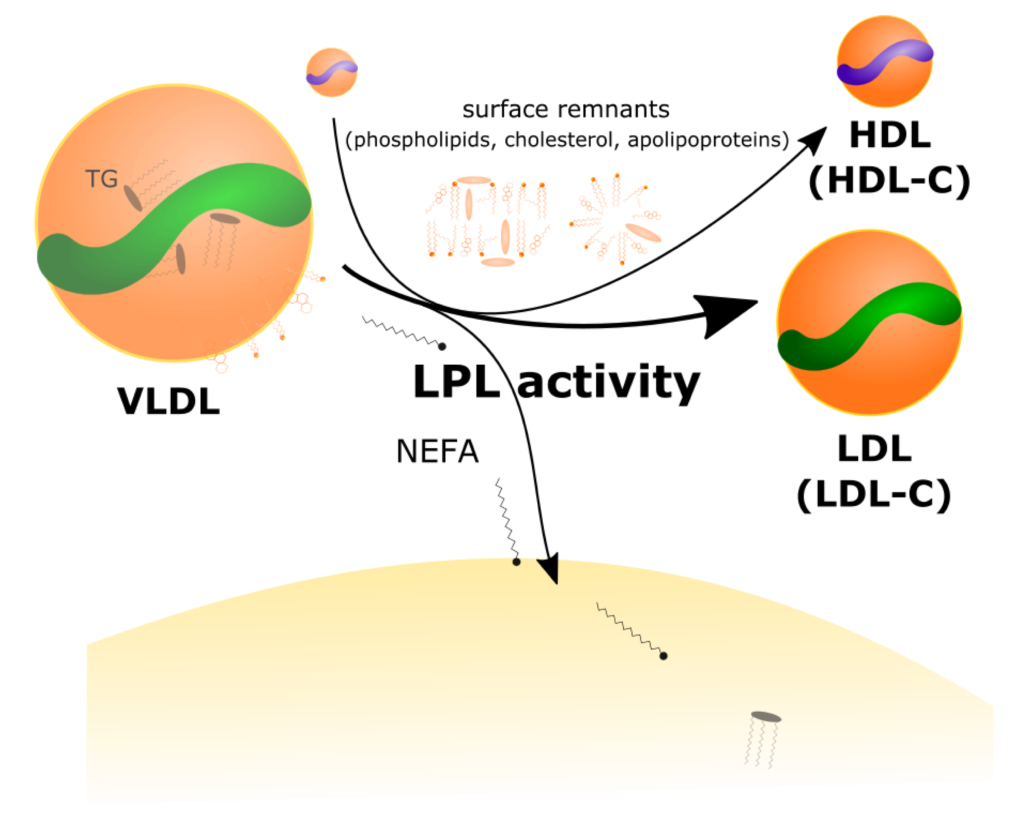
Cette dépendance accrue entraîne une augmentation de la sécrétion hépatique de VLDL et de la lipolyse de VLDL par la lipoprotéine lipase avec une production élevée d’acides gras libres (AGL), qui sont une source d’énergie importante de l’organisme.
Ensuite, l’absorption périphérique de ces acides augmente, comme l’accumulation dans la circulation de LDL (qui est le produit terminal de la lipolyse de VLDL) et le taux de LDL-C. En parallèle, les fragments de la surface de VLDL contenant le cholestérol sont libérés et transférés aux HDL, résultant en élévation marquée de HDL-C. Enfin, les taux circulants de triglycérides diminuent suite à la lipolyse. Selon le Lipid Energy Model (LEM), cette voie est particulièrement active chez des individus maigres avec un faible rapport TG/HDL-C au baseline, parce que ces individus sont caractérisés par une lipolyse de VLDL particulièrement efficace.
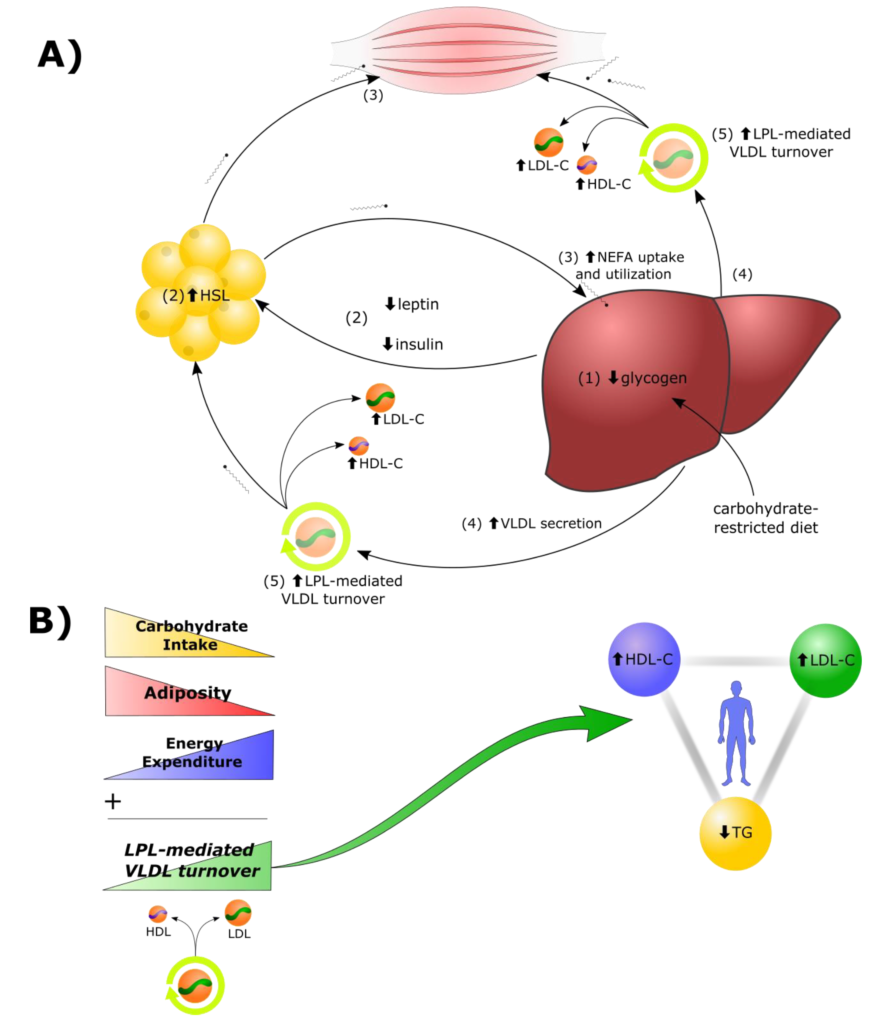
Schéma du modèle énergétique lipidique
(A) Dans le contexte d’une restriction glucidique, (1) l’épuisement du glycogène et (2) les modifications des hormones circulantes stimulent la sécrétion d’acides gras libres (AGL = NEFA) par les adipocytes à l’aide de la lipase hormonosensible (HSL) pour alimenter les tissus oxydatifs. (3) Le foie capte les NEFA circulants et les reconditionne en triglycérides (TG), (4) sécrétés à bord des VLDL. (5) L’augmentation de la destruction des VLDL médiée par la lipoprotéine-lipase (LPL) génère une augmentation du LDL-C et du HDL-C. (B) L’ampleur de la restriction glucidique, l’adiposité et la dépense énergétique contribuent chacune, en tant que variables indépendantes, au degré de renouvellement des VLDL médié par les LPL et, par conséquent, à l’ampleur de la variation des composants de la triade. Source : Metabolites 2022, 12(5), 460.
Quelle est la conclusion de ce travail de recherche ?
Le travail de recherche réalisé conclut que le Lipid Energy Model (LEM) pourrait expliquer l’association inverse observée entre l’IMC (Indice de Masse Corporelle) de l’individu, et la modification de son taux de cholestérol LDL dans un contexte de restriction des glucides consommées. En effet, les taux élevés de cholestérol LDL sont un facteur important de risque cardiovasculaire. Ce travail appelle donc impérativement à des recherches supplémentaires pour évaluer ce risque chez des individus suivant des régimes pauvres en glucides.
Ce modèle fournit des prédictions spécifiques et vérifiables qui seront à évaluer dans de futures études, afin de mieux comprendre les mécanismes sous-jacents au changement du cholestérol LDL dans les régimes pauvres en glucides. Cela permettra de faire progresser nos connaissances sur la dynamique des lipides et des lipoprotéines dans le métabolisme humain.
Les auteurs de la publication : Nicholas G.Norwitz, Adrian Soto-Mota, Bob Kaplan, David S. Ludwig, Matthieu Boudoff, Anatol Kontush, David Felman.
L’excellence de la plateforme ICAN Omics lipidomics
L’IHU ICAN possède une plateforme « lipidomics » spécialisée dans les maladies métaboliques (NASH, T2DM, athérosclérose, hypercholestérolémie, cardiomyopathie…) qui combine des approches métabolomiques, lipidomiques et des outils bioinformatiques. Grâce à des technologies de pointe, elle permet d’identifier des nouveaux biomarqueurs pour améliorer la prédiction des pathologies métaboliques
Située à l’hôpital de la Pitié-Salpêtrière à Paris, notre plateforme a obtenu le label IBiSA (Infrastructures en Biologie Santé et Agronomie) en 2021.








