- Accueil
- Les équipes de recherche
- Équipe de recherche 3 – Plasticité Moléculaire et Cellulaire dans les Maladies Cardiovasculaires
Équipe 3 - Plasticité Moléculaire et Cellulaire dans les Maladies Cardiovasculaires
Depuis plus de 15 ans, notre groupe (https://recherche-cardiovasculaire-metabolique.fr) est impliqué dans le décryptage des mécanismes génétiques et cellulaires de ces maladies. Nous avons récemment identifié l’implication de nouveaux variants génétiques grâce à l’étude du génome entier. Ces nouvelles connaissances nous permettent de mieux comprendre ces maladies, de progresser vers une médecine personnalisée, font entrevoir de nouvelles approches thérapeutiques.
Recherches menées actuellement
Thème 1 - Mécanismes moléculaires de l'expression membranaire des canaux ioniques dans les myocytes cardiaques – Elise Balse
L’expression fonctionnelle des canaux ioniques dans la membrane des myocytes détermine la forme et la durée du potentiel d’action, contrôlant ainsi la période réfractaire effective du myocarde. L’expression des canaux ioniques peut être perturbée à plusieurs niveaux, de leur biosynthèse à leur ciblage final dans la membrane.
Nous étudions :
- les modifications de la machinerie de trafic dans les cardiopathies acquises et leur rôle dans la formation du substrat arythmogène. (Boycott et al., PNAS 2013 ; Melgari et al., JMCC 2020) ;
- la régulation de la polarité électrique et structurelle du myocyte pilotée par les protéines partenaires des canaux ioniques (Eichel et al., Circ Res 2016 ; Beuriot et al., Heart Rhythm 2020).
Thème 2 - Mécanismes du remodelage cardiaque lié à l'âge : Rôle des voies FoxO et NFkB – Sophie Besse et Bruno Riou
Notre groupe s’intéresse aux mécanismes impliqués dans le vieillissement cardiaque (Carillion et al., 2015 ; Launay et al., 2017). La production d’espèces réactives de l’oxygène (ROS), une caractéristique du vieillissement, module l’activation/inactivation de différents facteurs de transcription tels que NF-κB et FoxOs qui, à leur tour, régulent de nombreuses voies cellulaires dont l’inflammation, la nécrose/apoptose, l’homéostasie ionique, l’hypertrophie des myocytes et le remodelage de la matrice extracellulaire. Nous étudions actuellement les altérations associées à l’âge des voies FoxO et NF-κB dans le cœur des rongeurs mais aussi dans les oreillettes humaines qui restent largement inexplorées au cours du vieillissement et des maladies associées à l’âge telles que la fibrillation auriculaire et le diabète.
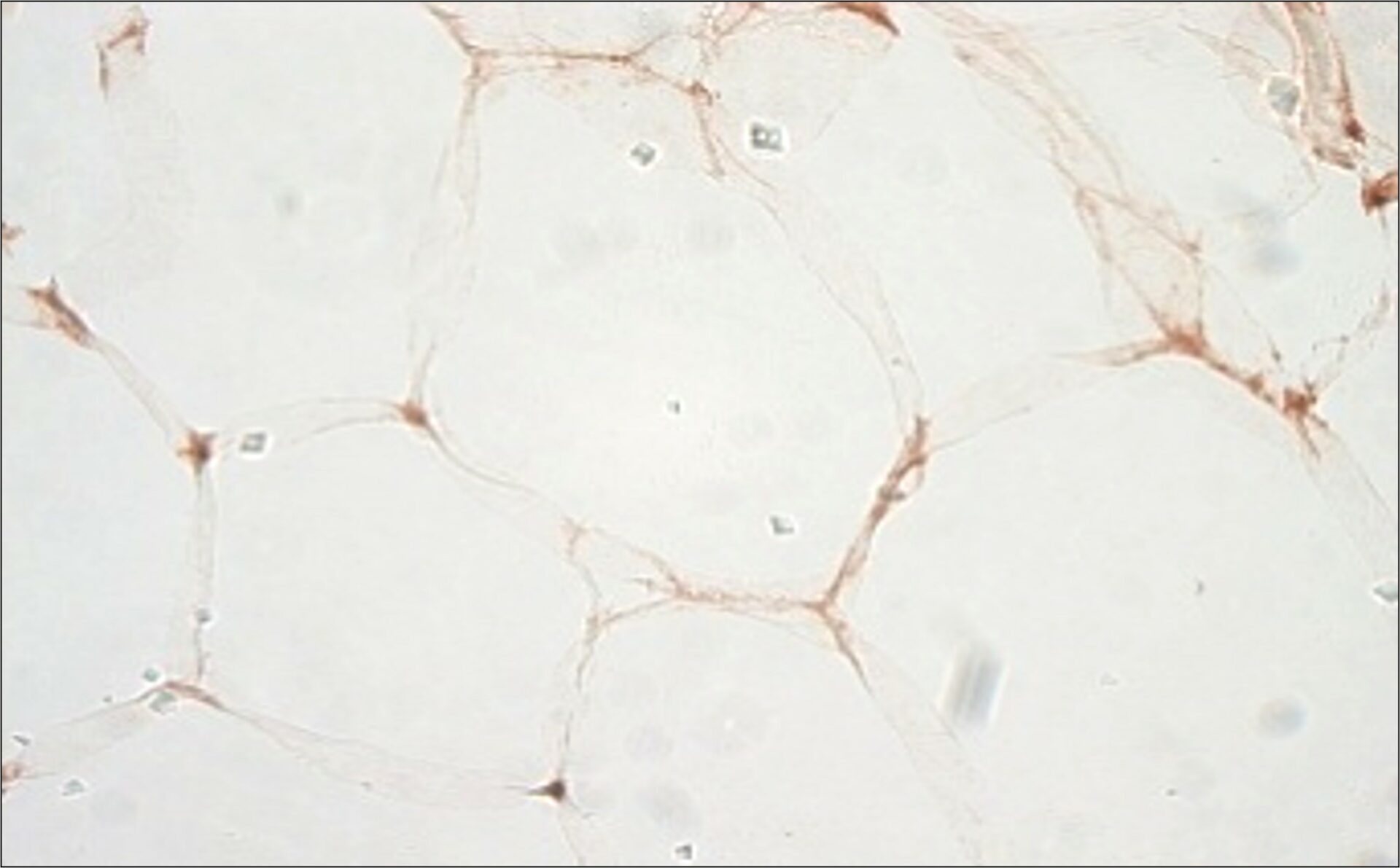
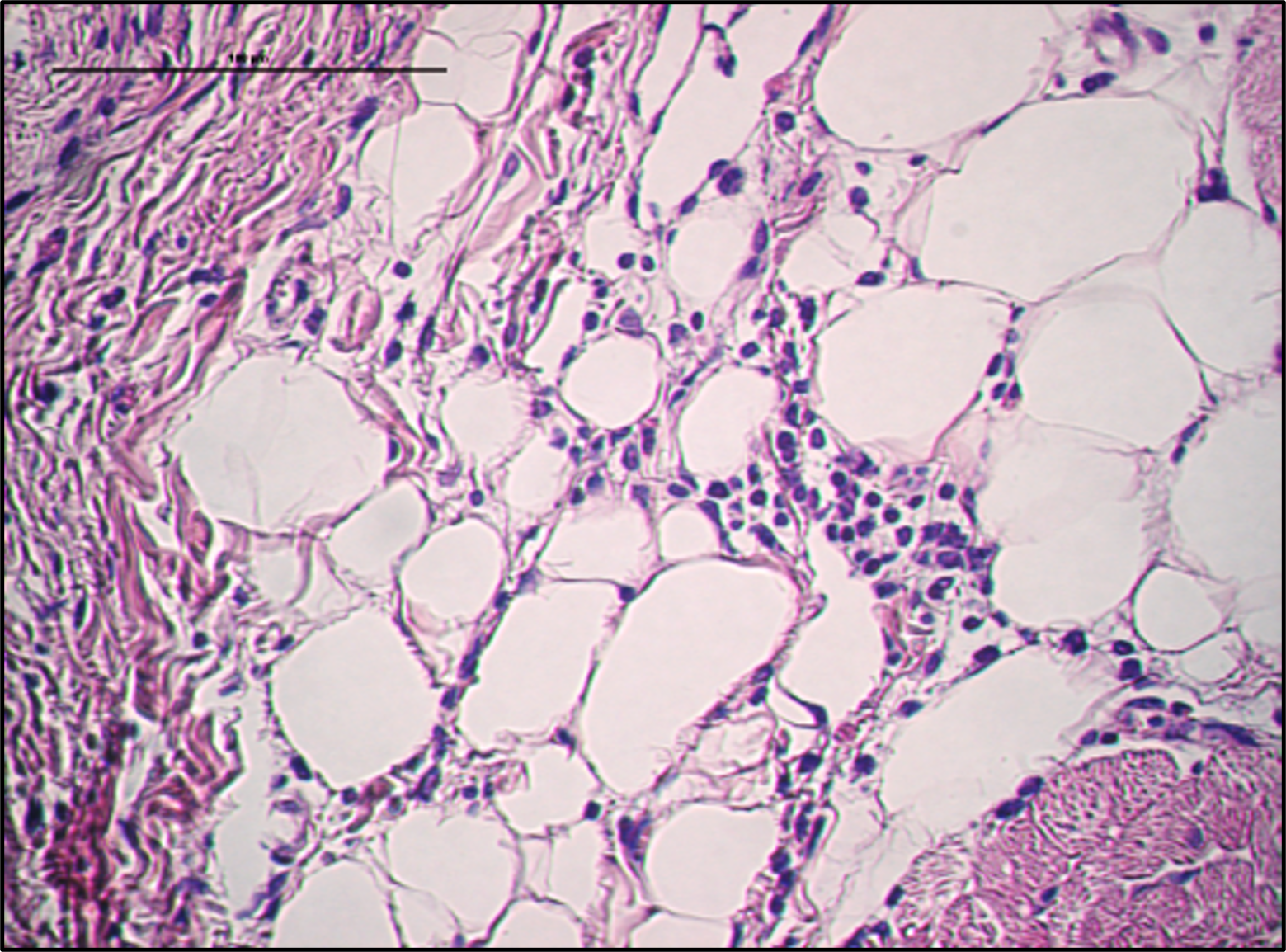
Thème 3 – Physiopathologie de la cardiomyopathie auriculaire et de la fibrillation auriculaire – Stéphane Hatem
Un certain nombre d’études cliniques ont établi que l’accumulation de tissu adipeux à la surface de l’oreillette est un facteur de risque majeur de fibrillation auriculaire, notamment lors de troubles métaboliques tels que l’obésité (Hatem JACC 2016). Le groupe de Stéphane Hatem a été le premier à démontrer un lien de causalité entre le tissu adipeux épicardique et la fibrillation auriculaire. Récemment, ils ont identifié une sous-population de progéniteurs épicardiques engagés vers une différenciation adipocytaire ou fibroblastique (Suffee, Circ Res, 2020). Ils caractérisent maintenant la régulation de ces voies de signalisation qui régissent un tel changement.
Thème 4 – Le rôle des cellules immunitaires et inflammatoires au cours du remodelage cardiovasculaire menant à l'insuffisance cardiaque – Catherine Pavoine
Notre groupe s’intéresse au remodelage cardiaque provoqué par l’activation du système nerveux sympathique ou en réponse à une surcharge de pression. Nous nous sommes concentrés sur les réponses d’hypertrophie et de fibrose conduisant à l’insuffisance cardiaque et sur le rôle bénéfique et néfaste, en fonction du temps, de la signalisation inflammatoire. Nous avons mis en évidence le rôle paracrine protecteur précoce des macrophages cardiaques (Keck et al., 2019). Nous avons récemment identifié l’axe CX3CL1/CX3CR1 comme déterminant dans le remodelage hypertrophique (Flamant et al, 2021 sous presse) et nous caractérisons maintenant l’évolution du profil transcriptomique et lipidomique des macrophages cardiaques.


Thème 5 – Plasticité cellulaire et moléculaire au cours du remodelage vasculaire pulmonaire dans l'hypertension artérielle pulmonaire – Sophie Nadaud
Notre groupe s’intéresse aux facteurs cellulaires et moléculaires impliqués dans les altérations de la structure vasculaire (remodelage). Nous étudions en particulier l’origine des nouvelles cellules musculaires lisses produites au cours de l’hypertension pulmonaire. Il s’agit d’une maladie rare et dévastatrice, sans option curative, caractérisée par un remodelage occlusif de la vascularisation pulmonaire distale qui conduit finalement à une insuffisance cardiaque droite. Nous avons identifié des cellules progénitrices vasculaires résidentes pulmonaires qui prolifèrent et génèrent de nouvelles cellules musculaires lisses vasculaires (Dierick, Circ Res 2016). Nous avons récemment démontré que la prolifération de ces cellules progénitrices est sous le contrôle de la voie PDGFRα
Thème 6 – Mécanismes cellulaires et moléculaires à la base du développement de la maladie veino-occlusive pulmonaire – Florent Soubrier
Nos projets portent sur :
la plasticité de la composition cellulaire des tissus cardiovasculaires. Nous étudions notamment la capacité des progéniteurs et des cellules souches à être recrutés, à se différencier en diverses lignées de cellules mésenchymateuses et à contribuer au remodelage auriculaire et vasculaire.
la plasticité des complexes protéiques macromoléculaires régulant la fonction cardiaque et leur rôle dans le dysfonctionnement de la pompe et les arythmies. Nous nous concentrons sur la régulation du trafic et du ciblage des canaux ioniques dans les cardiomyocytes.
le rôle des changements métaboliques cellulaires dans la régulation du remodelage myocardique et des propriétés électriques auriculaires.
le rôle des cellules immunitaires et inflammatoires au cours du remodelage cardiovasculaire menant à l’insuffisance cardiaque. Nous étudions les mécanismes du rôle protecteur des macrophages pendant l’hypertrophie cardiaque adaptative précoce.
le rôle du stress oxydatif et de l’inflammation pendant le remodelage cardiovasculaire associé à l’âge et la transition vers l’insuffisance cardiaque.
le rôle de la mutation du gène GCN2 dans le développement de la maladie veino-occlusive pulmonaire, une forme spécifique d’hypertension pulmonaire.

Publications majeures
Récompenses de l’équipe 3
Stéphane Hatem / Alain Castaigne – Award – 2018
Florent Soubrier / Jean Valade Award – 2014
Lamonica Cardiology – Award – Académie des Sciences – 2017
France Diérick / Marion Elizabeth Brancher – Award – 2017


